![[論文紹介]がん免疫の新常識?「自分の血液」でがんを倒すT細胞を育てる技術](https://images.unsplash.com/photo-1576086213369-97a306d36557?w=800&h=400&fit=crop)
[論文紹介] がん免疫の新常識?「自分の血液」でがんを倒すT細胞を育てる技術
⸻
導入
日本で最も多い死因はがんであると、厚生労働省から報告されています[1]。これは、がん治療の開発が最も重要な医療課題の一つであることを意味しています。現在、がんの治療には主に手術、抗がん剤治療、放射線治療の3つがありますが、最近では患者自身の免疫の力を活用してがんを治療する「がん免疫療法」が注目されています。
とはいえ、この免疫療法は誰にでも効くわけではなく、さまざまな課題が報告されています[2–5]。 今回紹介するのは、「血液からがんに効く自分専用の免疫細胞を育てる」という新たなアプローチです。
⸻
背景:がん免疫療法とは?
がん免疫療法とは、T細胞と呼ばれる免疫細胞ががん細胞を倒す力を利用する治療法です。T細胞は、がん細胞が表面に提示する「抗原」という目印を認識して、がん細胞を「敵」と判断し、攻撃します(図1)。
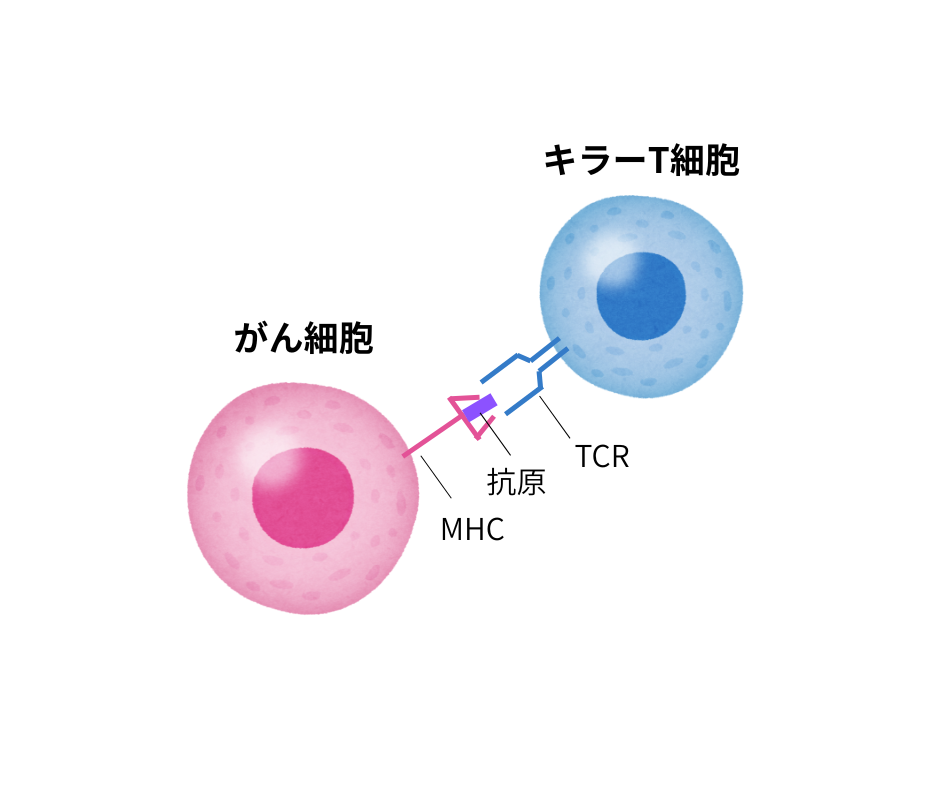
もともと人の体内にはこのような能力が備わっていますが、免疫療法ではがん組織から取り出した腫瘍反応性T細胞(TIL)を増やして再び体内に戻すことで、がんとの戦いを後押しするというのが基本的な仕組みです。
しかし、この治療法には以下のような限界があります:
- がんの遺伝子変異が少ないと、抗原が提示されてもT細胞が正常細胞との違いを識別できず、攻撃しにくい
- がん細胞が抗原提示のアンテナ(MHC分子)を十分に出していないと、T細胞がそれを認識できない
- がん細胞が「PD-L1」というブレーキ分子を出して、T細胞の攻撃力を抑えてしまう
さらに、がん組織を手術で採取する必要があり、患者の身体的負担が大きいという問題もあります。
⸻
本研究のアイデアとやり方(Dijkstraら, 2018)
こうした課題を解決する手がかりとして、オランダのDijkstra氏らの研究チームは、「血液中のT細胞を、がんのミニチュアモデルであるオルガノイドと一緒に培養するだけで、がんに反応するT細胞を育てられる」という新たな手法を提案しました[6]。
オルガノイドとは、臓器の構造や機能を模倣した3次元培養モデルで、がん患者の腫瘍から作成されます。
この研究では、
• がん組織から作成した腫瘍オルガノイド
• 同じ患者の血液から取り出したT細胞(PBMC)
を共培養し、T細胞ががんに特異的に反応する能力を獲得するかどうかを検証しました。
実験結果の概要
• 共培養前は反応しなかったT細胞が、共培養後にがん細胞に反応し、殺傷能力を示すようになった(図2, 3)
• がん細胞の生存率は低下し(図6)、一方で正常細胞には反応しなかった(図4)
臨床応用への手応え
実際にこの方法を患者由来サンプルで試したところ、
• 大腸がん患者13名中4名(31%)
• 非小細胞肺がん患者6名中2名(33%)
で、がんに反応するT細胞を血液から誘導することに成功しました。
⸻
研究の残っている課題
筆者としては、この研究が臨床応用に至るまでに2つの課題が残っていると考えています(※一部推測が含まれることをご了承ください)。
① 腫瘍組織の採取問題
オルガノイドを作成するには腫瘍組織が必要ですが、がん種や病期によっては生検や手術が難しいケースもあります。特に転移がんや再発後など、治療の途中段階での採取は困難なこともあるでしょう。
② 反応性T細胞の誘導率の限界(約30%)
本研究ではT細胞の反応性獲得に成功したのは約30%にとどまっています。この理由として、以下のようながん細胞の免疫逃避機構が挙げられます:
• がんに変異が少なく、異物としての「抗原」が目立たない
• MHC分子の発現が少なく、T細胞に認識されにくい
• PD-L1の発現によってT細胞にブレーキがかかる
これらの問題を単独の方法だけで乗り越えるのは難しく、免疫チェックポイント阻害薬などの治療と併用することが現実的かもしれません。
⸻
終わりに:未来のがん治療へ
本研究は、「血液から個別化されたがん治療用T細胞をつくる」という革新的なアプローチを提示しています。これまでのように手術で大きな腫瘍を取り出す必要がなく、患者の負担が軽く、より早期・個別対応の治療が可能になる未来を見据えた技術です。
今後、より多くのがん種や患者にこの技術を広げていくには、オルガノイド培養の技術革新やT細胞選別法の改良が必要ですが、「自分の細胞でがんと闘う」個別化免疫療法の実現に向けた大きな一歩となることは間違いありません。
⸻
今後も本サイトでは、論文の内容を紹介していく予定です!それではまた!
⸻
用語解説
キラーT細胞(CD8⁺ T細胞) がん細胞やウイルスに感染した細胞を直接攻撃するT細胞。標的細胞が提示する抗原をMHCクラスI分子を介して認識し、細胞障害性を発揮する。
腫瘍浸潤リンパ球(TIL:Tumor Infiltrating Lymphocyte) 腫瘍組織内に自然に存在するT細胞で、がんに特異的な反応性を持つ。TILを分離・増殖させて体内に戻す治療法は、がん免疫療法の一つとして確立されている。
抗原 免疫細胞が「異物」として認識する目印となる分子。細菌やウイルスの成分、がん細胞由来の変異タンパク質などが抗原となる。
主要組織適合性複合体(MHC:Major Histocompatibility Complex) 細胞が自身の中の抗原情報をT細胞に提示するための分子群。MHCクラスIはすべての有核細胞に発現し、CD8⁺ T細胞による認識に関与する。
TLR(Toll-like receptor:トール様受容体) 自然免疫系に属するパターン認識受容体の一種。細菌やウイルス、真菌などの病原体由来の構造(PAMPs:病原体関連分子パターン)を識別し、免疫応答を誘導する。ヒトでは10種類以上のTLRが知られており、それぞれ異なるリガンドを認識する。TLRの活性化は、炎症性サイトカインの産生や樹状細胞の活性化などを通じて、後続の獲得免疫応答にも影響を与える。がん免疫療法においても、TLRアゴニスト(作動薬)はワクチンやアジュバントとして応用が進められている。
オルガノイド 幹細胞やがん細胞から三次元的に培養して作られる、臓器や腫瘍を模倣したモデル。組織構造や遺伝的特徴を保持しており、創薬や免疫研究に応用されている。
PBMC(Peripheral Blood Mononuclear Cells:末梢血単核細胞) 末梢血から遠心分離で分離される、単核の白血球群。主にT細胞、B細胞、単球などが含まれ、免疫学研究や細胞治療において重要な細胞源となる。
PD-L1(Programmed Death-Ligand 1) がん細胞や一部の免疫細胞が発現する免疫抑制分子。T細胞上のPD-1と結合することで、T細胞の活性化を抑制し、がん細胞の免疫逃避に関与する。PD-L1とPD-1の結合を阻害する免疫チェックポイント阻害薬は、がん治療の新たな選択肢として臨床応用されている。
⸻
参考文献
- 厚生労働省「人口動態統計」
- C.U. Blank, T.N. Schumacher, Science, 2016.
- K.K. Dijkstra, E.E. Voest, JAMA Oncol., 2016.
- J.M. Pitt, L. Zitvogel, Immunity, 2016.
- P. Sharma, A. Ribas, Cell, 2017.
- K.K. Dijkstra, E.E. Voest, Cell, 2018.

